一個(gè)月內(nèi)4款進(jìn)口藥獲批!跨國(guó)藥企說(shuō)“被新藥追著跑”,他們都在布局這個(gè)……
日期:2018/10/6
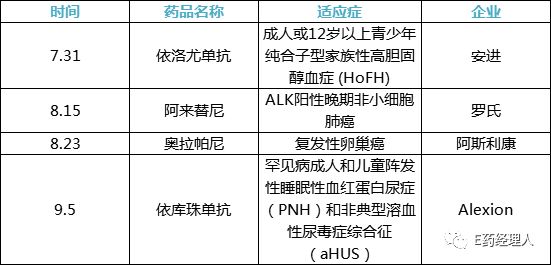
跨國(guó)藥企進(jìn)口新藥加速在華上市。據(jù)E藥經(jīng)理人不完全統(tǒng)計(jì),從7月31日安進(jìn)的依洛尤單抗注射液獲批開(kāi)始至9月9日Alexion公司的依庫(kù)珠單抗上市一個(gè)月時(shí)間內(nèi),至少4款進(jìn)口新藥在中國(guó)上市。
在2018年9月6日召開(kāi)的“第三屆中華醫(yī)學(xué)事務(wù)年會(huì)”上,輝瑞大中華區(qū)副總裁,醫(yī)學(xué)事務(wù)部負(fù)責(zé)人谷成明表示:“以前審批慢,新藥遲遲進(jìn)不來(lái),現(xiàn)在是新藥追著醫(yī)學(xué)部跑,我們必須盡快拿出適合中國(guó)患者的臨床方案出來(lái)。”
正如這位負(fù)責(zé)人所說(shuō),新藥上市之后,快速打通醫(yī)保路徑以及針對(duì)中國(guó)患者制定臨床診療方案是兩個(gè)最緊迫的任務(wù)。在此前,由于新藥進(jìn)口上市的時(shí)間漫長(zhǎng),長(zhǎng)達(dá)幾年,跨國(guó)藥企有足夠的時(shí)間進(jìn)行市場(chǎng)調(diào)研,另外,在原本的“三報(bào)三批”要求下,新藥上市時(shí)已經(jīng)完成了針對(duì)中國(guó)患者臨床試驗(yàn),從而形成上市后的診療方案。
如今,這些環(huán)節(jié)已經(jīng)被取消,在“被新藥追著跑”的新形勢(shì)下,跨國(guó)藥企會(huì)怎么做?這時(shí),真實(shí)世界研究(RWS)的需求陡然上升,成為跨國(guó)藥企重金布局之地。
被新藥“追”著跑
2018年8月8日,CDE在官網(wǎng)發(fā)布《關(guān)于征求境外已上市臨床急需新藥名單意見(jiàn)的通知》,48個(gè)境外已上市罕見(jiàn)病、兒童用藥等臨床急需新藥上榜,這些藥物將有機(jī)會(huì)免臨床試驗(yàn)直接在中國(guó)上市。這表明,中國(guó)在引入進(jìn)口新藥的力度和幅度上又加大了一步。
這48個(gè)新藥中,有4個(gè)品種已經(jīng)獲批上市,22個(gè)品種已有企業(yè)申報(bào)或正在進(jìn)行臨床試驗(yàn)。《通知》發(fā)布之后,相關(guān)藥企迅速提交資料申報(bào)上市。在9月11號(hào)公布的第32批優(yōu)先審評(píng)審批藥品名單中,諾華的布林佐胺溴莫尼定滴眼液、愛(ài)可泰隆的Selexipag片均是以國(guó)際多中心臨床試驗(yàn)數(shù)據(jù)申請(qǐng)進(jìn)口上市。
一致性評(píng)價(jià)政策結(jié)束了原研藥在中國(guó)市場(chǎng)的好日子,但同時(shí)新藥進(jìn)口的通道大大放開(kāi),此前比國(guó)際上市速度平均晚5年左右的情況不復(fù)存在:2017年3月,《關(guān)于調(diào)整進(jìn)口藥品注冊(cè)管理有關(guān)事項(xiàng)的決定》征求意見(jiàn)稿發(fā)布;2017年12月20日,《臨床急需藥品有條件批準(zhǔn)上市的技術(shù)指南(征求意見(jiàn)稿)》發(fā)布;2018年6月國(guó)務(wù)院常務(wù)會(huì)議要求部分國(guó)外已上市藥品提交資料即可直接申報(bào)國(guó)內(nèi)上市。新藥中外“時(shí)差”正在消失。
跨國(guó)藥企將加速新藥引進(jìn)視為應(yīng)對(duì)一致性評(píng)價(jià)、并在中國(guó)市場(chǎng)“反擊”的重要策略。數(shù)字能更直觀的體現(xiàn):根據(jù)原國(guó)家食藥監(jiān)總局發(fā)布的《2017年度藥品審評(píng)報(bào)告》,2017年共有116個(gè)進(jìn)口藥品獲批上市,其中53個(gè)被納入優(yōu)先審評(píng)審批,數(shù)量達(dá)到十年之最。而2018年,進(jìn)口新藥獲批的消息更加頻繁:7月31日,安進(jìn)依洛尤單抗注射液獲批上市;8月15日,羅氏新一代ALK抑制劑阿來(lái)替尼上市;8月23日,阿斯利康的奧拉帕尼上市。而瑞士Alexion公司的依庫(kù)珠單抗本已在國(guó)內(nèi)申請(qǐng)臨床,進(jìn)入48品種名單之后于9月5日火速上市。
這些進(jìn)口新藥中包含有條件批準(zhǔn)上市品種、境外臨床試驗(yàn)數(shù)據(jù)申請(qǐng)進(jìn)口的品種,由于人種差異等因素,根據(jù)法律法規(guī),這些新藥上市后仍需要完成臨床試驗(yàn)、人種差異試驗(yàn)、補(bǔ)充上市后的有效性和安全性信息、提供針對(duì)中國(guó)或亞裔人群的療效安全性一致分析報(bào)告等。這些動(dòng)作的完成速度將直接決定新藥放量速度。谷成明說(shuō):“上市之后第一件事一定是鋪市場(chǎng),這意味著有很多工作需要做。”
此外,國(guó)家藥價(jià)談判中納入剛上市不久的新藥,也越來(lái)越成為一種趨勢(shì)和慣常操作手法。這需要跨國(guó)藥企針對(duì)產(chǎn)品藥物經(jīng)濟(jì)學(xué)、中國(guó)患者流行病學(xué)等快速確定產(chǎn)品合理價(jià)格,從而決定是否參加談判。
那么對(duì)于一個(gè)陌生市場(chǎng)的疾病領(lǐng)域,如何快速獲得相應(yīng)的數(shù)據(jù)?
最重要的事
數(shù)字化和真實(shí)世界研究(RWS)的重要性在此時(shí)凸顯出來(lái)。
RWS并不是一個(gè)新概念,最早是應(yīng)用在公共衛(wèi)生領(lǐng)域,比如流行病學(xué)調(diào)查。相較于傳統(tǒng)的RCT研究,RWS可以收集真實(shí)世界中的治療情況,進(jìn)行標(biāo)準(zhǔn)化處理之后,可以為臨床使用新藥提供真實(shí)世界模型。不僅可以借此設(shè)計(jì)臨床治療方案,還能大大節(jié)省時(shí)間和成本。隨著新藥在中國(guó)市場(chǎng)的快速引進(jìn),RWS在中國(guó)的需求量快速上升。
在剛剛過(guò)去的ASCO大會(huì)現(xiàn)場(chǎng),羅氏制藥重點(diǎn)闡述了對(duì)RWS的投資使自己獲得回報(bào)的具體案例。剛剛在中國(guó)獲批的阿來(lái)替尼是一款肺癌藥物,由于開(kāi)發(fā)速度迅速,阿來(lái)替尼在與支付方進(jìn)行醫(yī)保談判時(shí)還沒(méi)有完整的數(shù)據(jù),此時(shí)一家基于云計(jì)算技術(shù)的腫瘤分析公司Flatiron利用自己的數(shù)據(jù)庫(kù)模仿了全球不同市場(chǎng)的標(biāo)準(zhǔn)療法。羅氏制藥CEO DanielO’Day在ASCO大會(huì)上表示:“通過(guò)這個(gè)方法,我們?cè)谌蚪?0個(gè)國(guó)家的獲批速度平均下來(lái)比傳統(tǒng)的醫(yī)保流程快了近1年!”
另一個(gè)案例是,一款藥物被英國(guó)NICE(衛(wèi)生技術(shù)效益監(jiān)管機(jī)構(gòu))獲批需要有5年的相關(guān)數(shù)據(jù),羅氏的PD-L1藥物Tecentriq已經(jīng)獲得了2.5年的數(shù)據(jù),利用Flatiron數(shù)據(jù)庫(kù)模擬了5年的數(shù)據(jù),Tecentriq成為首個(gè)在英國(guó)獲批的肺癌二線腫瘤免疫療法。
2018年2月,羅氏制藥斥資19億美元收購(gòu)Flatiron剩余的股份,從而完全控股了這家腫瘤分析公司,加大了在信息化和真實(shí)世界數(shù)據(jù)上的投資力度。羅氏表示將尋求利用RWS幫助醫(yī)保流程、推動(dòng)藥物開(kāi)發(fā)、支持法規(guī)注冊(cè)等多方面。
中國(guó)的RWS研究起步較晚,但也正迎來(lái)快速發(fā)展的時(shí)機(jī)。人工智能與醫(yī)療大數(shù)據(jù)公司零氪科技首席醫(yī)學(xué)官楊海英說(shuō):“最近兩年根據(jù)一期、二期研究數(shù)據(jù)就獲批上市的新產(chǎn)品越來(lái)越多,來(lái)源于真實(shí)世界臨床實(shí)踐中的數(shù)據(jù)變得非常重要。而現(xiàn)在無(wú)論是FDA還是中國(guó)藥品監(jiān)督管理局,都已經(jīng)認(rèn)可了RWS在這方面的作用。”
在此次“第三屆中華醫(yī)學(xué)事務(wù)年會(huì)”上,大會(huì)組委會(huì)發(fā)布了《真實(shí)世界研究實(shí)踐專家共識(shí)》,這表明RWS越來(lái)越受到監(jiān)管部門和有關(guān)專家的關(guān)注。《共識(shí)》參考國(guó)外的RWS研究成果,探索將我國(guó)真實(shí)世界獲得的海量醫(yī)療數(shù)據(jù)轉(zhuǎn)化為真實(shí)世界證據(jù)的路徑和方法。零氪科技憑借在智能化數(shù)據(jù)處理、將真實(shí)世界數(shù)據(jù)進(jìn)行標(biāo)準(zhǔn)化和結(jié)構(gòu)化方面的能力,共同參與了《共識(shí)》的編寫(xiě)。

《真實(shí)世界研究實(shí)踐專家共識(shí)》在上海發(fā)布
趨勢(shì)來(lái)自真實(shí)的需求,信息處理能力的進(jìn)步、數(shù)據(jù)標(biāo)準(zhǔn)化的加強(qiáng),都會(huì)使RWS在中國(guó)越來(lái)越成熟。《共識(shí)》發(fā)布現(xiàn)場(chǎng),西安楊森醫(yī)學(xué)副總裁李濱說(shuō):“我們很多數(shù)據(jù)往往來(lái)自總部,我們用總部的數(shù)據(jù)去跟醫(yī)生去溝通。但實(shí)際上有很多未滿足的需求來(lái)自于中國(guó)真實(shí)世界,醫(yī)生也有這方面的需求。”零氪科技首席運(yùn)營(yíng)官丁利華在接受E藥經(jīng)理人采訪時(shí)表示:“目前我們的外企客戶包括阿斯利康、羅氏、輝瑞、諾華等等,從患者管理到產(chǎn)品的RWS、上市以后的再評(píng)價(jià)等都有合作。國(guó)外已經(jīng)有上千家醫(yī)療大數(shù)據(jù)公司,我相信競(jìng)爭(zhēng)對(duì)手會(huì)越來(lái)越多,這個(gè)賽道的入局者也會(huì)也來(lái)越多。”
本文版權(quán)屬于E藥臉譜網(wǎng)(www.y-lp.com),轉(zhuǎn)載請(qǐng)注明出處。
|